Category: Cell Organization and Movement
The small GTP-binding proteins Cdc42, Rac, and Rho control actin organization
Cell migration coordinates force generation with cell adhesion and membrane recycling
A moving fibroblast (connective tissue cells) displays a characteristic sequence of events:
- initial extension of a membrane protrusion
- attachment to the substratum
- forward flow of cytosol
- retraction of the rear of the cell
These events occur in an ordered pattern in a slowly moving cell such as a fibroblast, but rapidly moving cells, such as macrophages, all of them are occurring simultaneously in a coordinated manner. We first consider the role of the actin cytoskeleton, and then the involvement of the endocytic cycle.
Membrane extension
The network of actin filaments at the leading edge is a type of cellular engine that pushes the membrane forward in a manner very similar to the propulsion of Listeria by actin polymerization. Thus at the membrane of the leading edge, actin is nucleated by the activated Arp2/3 complex and filaments are elongated by assembly onto (+) ends adjacent to the plasma membrane.
As the actin meshwork is fixed with respect to the substratum, the front membrane is pushed out as the filaments elongated. This is vey similar to Listeria, which “rides” on the polymerizing actin tail, which is also fixed within the cytoplasm. Actin turnover, and thus treadmiling, is mediated, as it is in the comet tails of Listeria, by the action of profilin and cofilin.
Cell-substrate adhesions
When the membrane has been extended and the cytoskeleton has been assembled, the plasma membrane becomes firmly attached to the substratum. Time-lapse microscopy shows that actin bundles in the leading edge become anchored to the structures known as focal adhesions.
The attachment serves 2 purposes:
- it prevents the leading lamella from retracting
- it attaches the cells to the substratum, allowing the cell to move forward.
Given the importance of focal adhesions and their regulation during cells locomotion, it is not surprising that they have been found to be rich in molecules involved in signal-transduction pathways.
The cell-adhesion molecules that mediate most cell-matrix interactions are membrane proteins called integrins. These proteins have an external domain that binds to specific components of the ECM, such as fibronectin and collagen, and a cytoplasmic domain that links them to the actin cytoskeleton.
The cell makes attachments at the front, and as the cell migrates forward, the adhesions eventually assume positions toward the back.
Cell-body translocation
After the forward attachments have been made, the bulk contents of the cell body are translocated forward. It believed that the nucleus and the other organelles embedded in the cytoskeleton are moved forward by myosin II-dependent cortical contraction in the rear part of the cell, like squeezing the lower half of the tube of toothpaste. Consistent with this model, myosin II is localized to the rear cell cortex.
Breaking cell attachments
Finally, in the last step of movement (de-adhesion), the focal adhesions at the rear of the cell are broken, the integrins recycled, and the freed tail brought forward. In the light microscope, the tail is often seen to “snap” loose from its connections- perhaps by the contraction of stress fibers in the tail or by elastic tension- and it sometimes leaves a little bit of its membrane behind, still firmly attached to the substratum.
Cells cannot move if they are either too strongly attached or not attached to a surface. The ability of a cell to move corresponds to a balance between the mechanical forces generated by the cytoskeleton and the resisting forces generated by cell adhesions. This relationship can demonstrated by measuring the rate of movement in cells that express varying levels of integrins. Such measurements show that the fastest migration occurs at an intermediate level of adhesion, with the rate of movement falling off at high and low levels of adhesion. Cell locomation thus results from traction forces exerted by the cell on the underlying substratum.
Recycling membrane and integrins by endocytosis
The dynamic changes in the actin cytoskeleton alone are not sufficient to drive cell migration; it is also dependent on endocytic recycling of membranes. The membrane needed during lamellipodium extension is provided by internal endosomes following their exocytosis.
Adhesion molecules in focal adhesions at the rear of the cell are internalized as those adhesions are disassembled and transported by an endocytic cycle to the front to make new substratum attachments.
This cycling of adhesion molecules in a migrating cell resembles the way a tank uses its treads to move forward. The movement of membrane internally through the cell also generates a rearward membrane flow across the surface of the cell.
Indeed, this type of flow may contribute to the mechanics of cell locomotion, as it has recently been found that white blood cells can move in a liquid (“swim”) in the absence of attachment to a substratum, presumably as surface structures operating like paddles move backward across the cell surface.
Retype from Lodish 8th Edition, p.811
Migrasi sel: mekanisme, pensinyalan, dan kemotaksis
Inilah mekanisme yang digunakan sel untuk bergerak:
- pembangunan filamen aktin
- pembentukan bundle filamen aktin
- beroperasi dalam jejaring ke kontraksi aktin dan myosin
- transport organel oleh molekul myosin sepanjang filamen aktin
Some of these same mechanisms constitute the major processes whereby cells generate the forces needed to migrate. Cell migration results from the coordination of motions generated in different parts of cells, integrated with a directed endocytic cycle.
Mempelajari migrasi sel penting dalam banyak bidang. Contohnya:
- an essential feature of perkemembangan hewan is the migration sel khusus along predetermined paths.
- Sel epitelial bermigrasi untuk menyembuhkan luka
- sel darah putih bermigrasi ke situs infeksi
- sel epitelial intestinal yang bermigrasi secara lambat dan kurang jelas sepanjang villi
- sel endotelial sepanjangan pembuluh darah yang bermigrasi lambat tapi konstan
- sel kanker yang bermigrasi secara tidak tepat yang berujung pada metastasis.
Migrasi sel diawali dengan pembentukan protrusi membran yang besar dan lebar pada leading edge of cells. Video hasil rekaman di bawah mikroskop menunjukkan a major feature of this movement is the polymerization of actin at the membrane.
actin filaments at the leading edge are rapidly cross-linked into bundles and networks in a protruding region, called a lamellipodium in vertebrate cells. in some cases, slender, fingerlike membrane projections, called filopodia, also extend from the leading edge.
these structures form stable contacts with the underlying surface (such as the ECM) that the cell moves across.
in this section, we take a closer look at how cells coordinate various microfilament-based processes with endocytosis to move across a surface. We also consider the role of signaling pathways in coordinating and integrating the actions of the cytoskeleton, a major focus of current research.
Referensi
Lodish 8th Edition, p.811
Moving out: invasion and metastasis
In the early phases of multi-step tumor progression, cancer cells multiply near the site where their ancestors first began uncontrolled proliferation. The result, usually apparent only after many years’s time, is a primary tumor mass. Given the fact that a cubic centimeter of tissue may contain as many as 10e9 cells, we can easily imagine that tumors may often reach a size of 10e10 or 10e11 cells before they become apparent to he individual carrying them or the clinician in search of them.
Primary tumors in some organ sites – specifically those arising within the peritoneal or pleural space – may well expand without causing any discomfort to the patient, simply because these cavities are expansible and their contents are quite plastic; in other site, such as the brain, the presence of a tumor is often apparent when it is still relatively small. Sooner or later, however, in all sites througout the body, tumors of substantial sizw compromise the functioning of the organs in which they have arisen and begin to evoke symtomps.
In many cases, the effects on normal tissue function come from the physicl pressure exerted by the expanding tumor masses. In others, cells from the primary tumor mass invade adjacent normal tissues and, in so doing, begin to compromise vital functions. Large tumors in the colon may obstruct passage of digestion products through the lumen, and in tissues such as the liver and pancreas, cancer cells may obstruct the flow of bile through critical ducts. In the lung, airways may be compromised.
As insidious and corrosive as these primary tumors are, they ultimately are responsible for only about 10% of deaths from cancer. The remaining approximately 90% of patients are struck down by cancerous growths that are discovered at sites far removed from the locations in their bodies where their primary tutors first arose. These metastases are formed by cancer cells that have left the primary tutor mass and traveled by the body’s highways – blood and lymphatic vessels – to seek out new sites throughout the body where they may found new colonies. Breast cancers often spawn metastatic colonies promiscuously in many tissues throughout the body, including the brain, liver, bones, and lungs. Prostate tutors are most often to the bones, while colon carcinomas preferentially form new colonies in the liver.
Such wandering cancer cells are the most dangerous manifestations of the cancer process. When they succeed in funding colonies in distant site, they often wreak great havoc. The female body can dispense with its mammary glands without losing vital physiological functions, and so almost all primary breast carcinomas do not compromise survival while they are confined to the breast. However, the metastatic colonies that breast cancer cells initiate in the bone can cause localised erosion of bone tissue, resulting in agonising pain and skeletal collapse. Metastases in the brain may rapidly compromise central nervous system function, while those in the lung or liver are similarly threatening to life because of the vital functions of these organs.
One major puzzle concerns the variable tendencies that different tumors have to metastasise. For reasons that remain obscure, tutors in certain tissues have a high probability of metastasising, while those arising in other tissues almost never do so. After primary melanomas penetrate a certain distance downward into the tissue underlying the skin, the presence of metastases at distant sites in the body is almost a certainty. In contrast, basal cell carcinomas of the skin and astrocytomas – primary tutors of the glial cells in the brain – rarely spawn metastases. Another major unresolved issue concerns the metastatic tropism cited above: Why do tutors originating in a given organ preferentially seed colonies in particular tissues located elsewhere in the body?
In a variety of human tutor types, the dissemination of cancer cells throughout the body has already occurred by the time a primary tutor is first detected; at the time of initial diagnosis, these scattered cells may be inapparent because they form only minute tutor colonies – micro metastases. Such behaviour provokes a question that we will confront int his chapter and again in Chapter 16: Do the properties of a primary tutor reveal whether it has broadcast cancer cells throughout the body that will eventually create life-threatening metastatic disease long after the primary tutor has beeb surgically removed?
In this chapter, we confront the processes that create these most aggressive products of tutor progression. These processes depend on complex biochemical and biological changes in cancer cells and in the associated storm. Most of the steps of cancer formation, as described in earlier chapters, are understood in considerable detail. In contrast, our understanding of invasion and metastasis is still quite incomplete, explaining why these late steps of tutor progression represent the major unsolved problems of cancer pathogenesis.
Retype from
The biology of Cancer second edition. Robert A weinberg, Garland Science
CAF mempromosikan migrasi sel kanker terarah dengan menyelaraskan fibronektin
Jumat kemarin (26 Januari 2018), jurnal club kala itu diisi dengan paparan tentang migrasi sel kanker yang dipandu oleh cancar-associated fibroblast (CAF). Paper dari JCB ini menarik, dan ternyata dapet skor tinggi juga di f1000.
Tujuan penelitian ini utamanya pengen tau gimana sih si CAF ini berperan mengatur migrasi sel kanker. Hasilnya ternyata si CAF ini menyelaraskan fibronektin, lalu CAF dan sel kanker berasosiasi dan sel kanker bisa pindah. Wah, macho banget ya CAF bagi sel tumor, sampe rela-rela nyediain jalan aspal alus digelari karpet merah fibronektin, khusus buat cinderella (sel kanker) lewat. Pengen tau cerita lengkapnya, yuk kupas dalam format Q/A berikut ini.
Apakah cancar-associated fibroblast (CAF)?
Sebelum bahas CAF, bahas fibroblast secara umum kali ya. Fibroblast adalah sel-sel utama di stroma. Fungsi kunci dari fibroblas normal (NF) adalah mempertahankan homeostasis ECM. Kata kunci homestasis, artinya stabil, seimbang supaya kerja sel tetap lancar jaya.
Sedangkan CAF, dia versi jahatnya, yang sudah sekongkol sama sel kanker makanya namanya cancer-associated fibroblast. Dia ngobrak-abrik kerjaan fibroblast asli. Dia memproduksi fibronektin serta kolagen tipe I dan II dalam jumlah banyak. Ga hanya itu, CAF juga mengubah arsitektur dan sifat fisik ECM, yang bisa mempengaruhi migrasi, invasi, dan pertumbuhan sel.
CAF pernah disidak ketahuan “menghancurkan” matriks kolagen I, trus kan ada bekasnya tuh, nah bekas puing-puing ini eh dimanfaatin ma sel kanker untuk lewat. Pernah juga ketahuan, CAF menata-nata serat matriks in vitro. Sedangkan, pada pasien tumor yang prognosisnya buruk juga ada tatanan serat ECM yang rapi. Eits, jangan-jangan kerjaan CAF juga ini.
Apakah fibronektin (Fn)?
Fibronektin merupakan salah satu protein ECM yang paling melimpah dan memediasi berbagai aktivitas seluler termasuk adhesi, migrasi, pertumbuhan, dan diferensiasi. Fn berikatan dengan protein ECM seperti kolagen, periostin, fibrillin, dan tenascin-C, dan memfasilitasi perakitan dan organisasinya. Ekspresi Fn yang menyimpang diketahui berkaitan dengan perkembangan tumor.
Fn dirakit menjadi serat melalui pengikatannya ke reseptor integrin transmembran. Integrin α5β1 adalah reseptor Fn utama dan memfasilitasi Fn fibrillogenesis dengan mengaktifkan kontraktilitas seluler dan menerapkan daya traksi ke Fn.
Apakah platelet-derived growth factor receptors (PDGFRs)?
Lho kok tetiba bahas PDGFR, apa kaitannya dengan interaksi CAF dan sel kanker? Kita ketahui pensinyalan faktor pertumbuhan penting dalam memperantarai interaksi sel kanker dengan stroma tumor untuk meningkatkan perkembangan tumor. Salah satu faktor pertumbuhan utama yang menghubungkan kanker dan sel stroma adalah PDGF. PDGF adalah aktivator kuat fibroblas melalui pengikatannya ke reseptor PDGF (PDGFR).
PDGFRs adalah reseptor tirosin kinase yang terdiri dari homo atau heterodimer dari dua rantai PDGFR: PDGFRα dan PDGFRβ. Sebagian besar sel kanker, termasuk karsinoma prostat mengekspresikan ligand PDGF tapi tidak mengeskpresikan PDGFR. Sebaliknya, CAF overexpress terhadap PDGFR dibandingkan dengan normal fibroblast. Selain itu, ligan PDGF yang disekresikan oleh sel kanker dikenal untuk menginduksi proliferasi, migrasi, dan perekrutan fibroblas stroma.
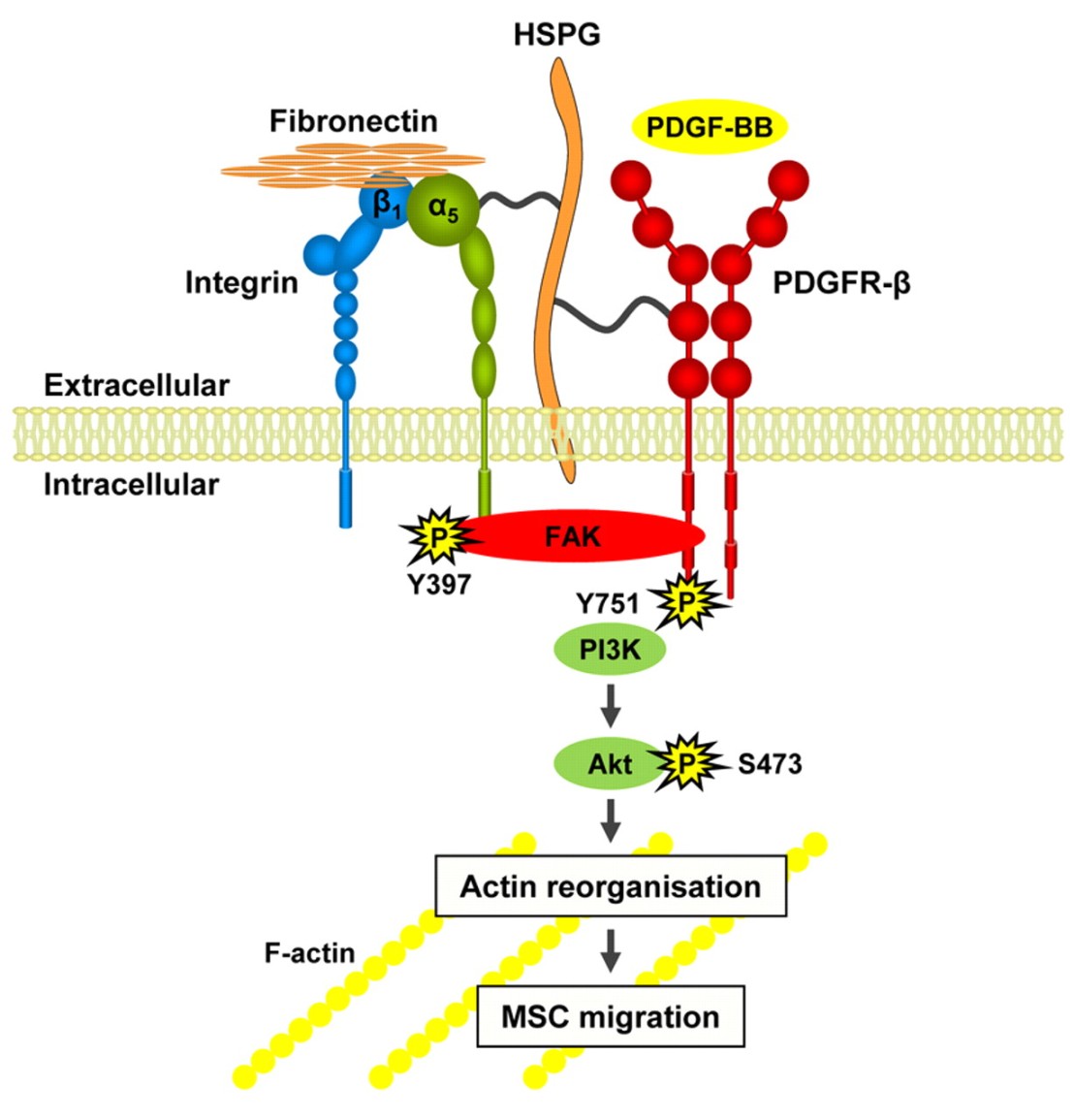
Apakah data baru yang dihasilkan dari penelitian ini?
Dalam penelitian ini, mereka menunjukkan bahwa Fn fibrillogenesis oleh CAFs mempromosikan interaksi sel kanker CAF dan memediasi migrasi terarah sel kanker dalam uji co-culture.
Matriks yang diperoleh sel kaya Fn (cell-derived matrices, CDMs) diisolasi dari kultur CAF, namun bukan NF, menunjukkan organisasi serat selaras dan mempromosikan migrasi sel kanker terarah.
Dibandingkan dengan NF, mereka menemukan bahwa organisasi matriks oleh CAFs dimediasi oleh kontraktilitas myosin-II yang ditingkatkan dan daya traksi meningkat, ditransduksi ke ECM melalui integrin α5β1.
Selanjutnya, mereka memberikan bukti bahwa aktivitas PDGFRα yang diatur dalam CAFs memiliki peran dalam kontraktilitas dan organisasi Fn yang sejajar. Mereka juga mengidentifikasi integrin αv sebagai pengatur migrasi sel kanker pada matriks CAF. Secara kolektif, mereka menunjukkan mekanisme baru yang mendorong interaksi sel kanker CAF dan migrasi sel kanker terarah.
F-aktin memiliki polaritas struktural dan fungsional
Semua subunit dalam filamen aktin diarahkan dengan cara yang sama. Akibatnya, secara keseluruhan filamen menunjukkan polaritas, artinya antar ujung berbeda. Salah satu ujung filamen lebih suka melakukan penambahan subunit aktin dan disebut sebagai ujung (+), sedangkan ujung satunya lebih suka untuk disosiasi dan disebut ujung (-).
Pada ujung (+), celah pengikatan ATP dari subunit aktin terminal kontak dengan subunit tetangga, sedangkan pada ujung (-), celah kontak dengan larutan sekitarnya (lihat Gambar l7-5b berikut).
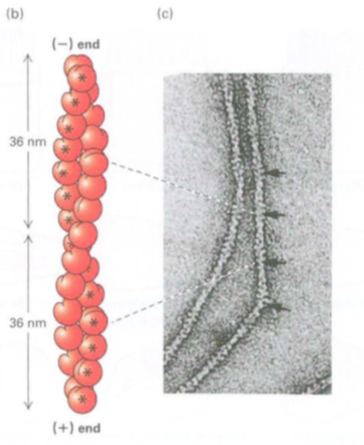
Gambar 17-5 (b) Filamen aktin berada dalam dua helai subunit. Satu unit berulang terdiri dari 28 subunit (14 di setiap untai, ditunjukkan oleh * untuk satu untai) dengan jarak 72 nm. Celah pengikatan ATP dari setiap subunit aktin berorientasi pada ujung filamen yang sama. Ujung filamen dengan celah terbuka yang terpapar adalah ujung (-); ujung yang berlawanan adalah ujung (+).
Celah pada subunit aktin dan polaritas filamen tidak dapat dideteksi tanpa resolusi atom dari kristalografi sinar-x. Namun, polaritas filamen aktin dapat ditunjukkan dengan mikroskop elektron dalam percobaan “asesori/hiasan”, yang memanfaatkan kemampuan protein motor myosin untuk mengikat secara spesifik filamen aktin.
Percobaan ini menggunakan myosin S1 dalam jumlah berlebih. Myosin mengandung domain kepala pengikat aktin, kemudian dicampur dengan filamen aktin. Myosin menempel pada sisi filamen dengan sedikit kemiringan. Ketika semua subunit aktin terikat oleh myosin, filamen tampak “dihiasi” dengan kepala panah yang mengarah ke salah satu ujung filamen (Gambar 17-6).

Gambar 17.6 Asesori Myosin S1 menunjukkan polaritas filamen aktin. Domain kepala Myosin S1 berikatan dengan subunit aktin dalam orientasi tertentu. Bila terikat pada semua subunit dalam filamen, S1 tampak berputar mengelilingi filamen. Lapisan kepala myosin ini menghasilkan serangkaian hiasan seperti panah (panah), yang paling mudah dilihat pada pemandangan filamen yang luas. Polaritas dalam dekorasi mendefinisikan ujung runcing (-) dan ujung berduri (+).
Kemampuan kepala myosin S1 untuk mengikat dan melapisi F-actin sangat berguna dalam eksperimen ini. Hal ini memungkinkan peneliti untuk mengidentifikasi polaritas filamen aktin, baik secara in vitro maupun dalam sel. Kepala panah mengarah ke ujung (-), sehingga ujung (-) sering disebut ujung “runcing/pointed end” dan ujung (+) dikenal sebagai ujung “barbed”.
Karena myosin berikatan dengan filamen aktin dan bukan pada mikrotubulus atau filamen perantara, hiasan panah adalah satu kriteria dimana filamen aktin dapat diidentifikasi secara pasti di antara serat sitoskeletal lainnya pada mikrograf elektron.
Referensi
Molecular Cell Biology Lodish, 8th Edition, chapter 17. p.780
Monomer G-aktin merakit ke polimer F-aktin yang panjang dan bentuknya heliks
Aktin berada sebagai monomer globular yang disebut G-actin dan sebagai polimer filamen yang disebut F-actin, yang merupakan rantai linier dari subunit G-aktin. Setiap molekul aktin mengandung ion Mg2+ yang dikomplekskan dengan ATP atau ADP. Pentingnya interkonversi antara ATP dan bentuk aktuat ADP dibahas kemudian.
Analisis kristalografi sinar-X menunjukkan bahwa monomer G-actin dipisahkan menjadi dua lobus oleh celah dalam (Gambar 17-5a). Pada bagian dasar celah adalah lipatan ATPase, tempat ATP dan Mg2+ terikat. Lantai celah berfungsi sebagai engsel yang memungkinkan lobus melenturkan relatif terhadap satu sama lain.
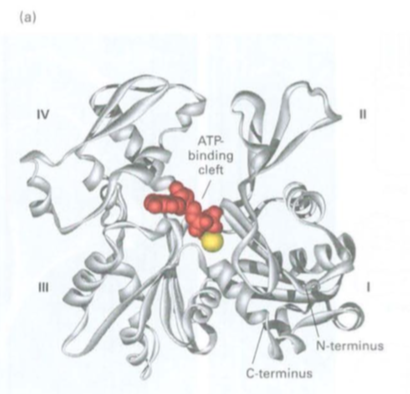
Gambar 17.5 Struktur filamen G-actin dan F-actin monomer. (a) Model monomer aktin (berukuran 5.5×5.5×5.5 nm) menunjukkan bahwa G-aktin dibagi oleh sumbatan sentral menjadi dua lobus berukuran sama dan empat subdomain, diberi nomor I-IV. ATP (merah) mengikat di bagian bawah celah dan kontak keduanya lobus (bola kuning mewakili Mg2+). N- dan C-terminal terletak di subdomain I.
Bila ATP atau ADP terikat pada G-aktin, nukleotida mempengaruhi konformasi molekul; Sebenarnya, tanpa nukleotida terikat, G-aktin terdenaturasi dengan sangat cepat.
Penambahan kation Mg2+, K+, atau Na+ – ke larutan G-aktin akan mencakup polimerisasi G-aktin menjadi filamen F-aktin.
Prosesnya reversibel: F-aktin didepolimerisasi menjadi G-aktin bila kekuatan ionik larutan diturunkan. Filamen F-aktin yang terbentuk secara in vitro tidak dapat dibedakan dari mikrofilamen yang terlihat pada sel, yang menunjukkan F-aktin adalah komponen utama mikrofilamen.
Dari hasil studi difraksi sinar-x pada filamen aktin dan struktur monomer aktin yang ditunjukkan pada Gambar 17-5a, para ilmuwan telah menentukan bahwa subunit dalam filamen aktin diatur dalam struktur heliks (Gambar 17-5b). Dalam susunan ini, filamen dapat dianggap dua heliks heliks saling melintang.

Gambar 17-5 (b) Filamen aktin tampak sebagai dua helai subunit. Satu unit berulang terdiri dari 28 subunit (14 di setiap untai, ditunjukkan oleh * untuk satu untai), yang mencakup jarak 72 nm. Celah pengikatan ATP dari setiap subunit aktin berorientasi pada ujung filamen yang sama. Ujung filamen dengan celah terbuka yang terpapar adalah ujung (-); ujung yang berlawanan adalah ujung (+).
Setiap subunit berada dalam struktur yang menghubungi satu subunit di atas, satu di bawah satu untai, dan dua di untai lainnya. Subunit dalam untaian angin tunggal di sekitar bagian belakang untai lainnya dan ulangi setelah 72 nm atau 14 subunit aktin. Karena ada dua helai, filamen aktin nampak mengulangi setiap 36 nm (lihat Gambar 17-5b). Ketika F-aktin diwarnai secara negatif dengan uranyl asetat untuk mikroskop elektron, nampak sebagai senar pilinan yang diameternya bervariasi antara 7 dan 9 nm (Gambar 17-5c).
Referensi
Molecular Cell Biology Lodish, 8th Edition, chapter 17
Aktin adalah kuno, melimpah, dan sangat dilestarikan
Sitoskeleton aktin melakukan berbagai fungsi dalam beragam jenis sel. Masing-masing subunit aktin, yang kadang-kadang disebut globular atau G-aktin, adalah polipeptida asam amino 375-amino yang membawa molekul ATP atau ADP yang terkait erat. Aktin sangat dilestarikan dengan baik di antara eukariota.
Urutan asam amino dari aktin dari spesies eukariotik yang berbeda biasanya sekitar 90% identik. Variasi kecil urutan asam amino aktin dapat menyebabkan perbedaan fungsional yang signifikan: Pada vertebrata, misalnya, ada tiga isoform aktin, yang disebut α, β, dan γ, yang sedikit berbeda dalam urutan asam amino dan memiliki fungsi yang berbeda. α-aktin hanya diekspresikan pada sel otot, sedangkan β- dan γ-aktin ditemukan bersamaan di hampir semua sel non-otot.
Aktin adalah protein intraseluler yang melimpah pada sel eukariotik. Pada sel otot, misalnya, aktin terdiri dari 10 persen berat protein sel total; bahkan di sel-sel non-otot, aktin menghasilkan 1-5 persen protein seluler. Konsentrasi sitosol aktin pada sel non-otot berkisar antara 0,1 sampai 0,4 mM; Dalam struktur khusus seperti mikrovili, konsentrasi aktin lokal bisa mencapai 5 mM.
Untuk membayangkan seberapa banyak aktin ada di dalam sel, pertimbangkan sel hati yang khas, yang memiliki 2 x 104 molekul reseptor insulin namun kira-kira 5 X 108, atau setengah miliar, molekul aktin. Karena mereka membentuk struktur yang meluas di sebagian besar interior sel, protein sitoskeletal termasuk protein paling banyak di dalam sel.
Actin disandi oleh keluarga besar gen yang menghasilkan beberapa protein yang paling lestari di dalam dan di seluruh spesies. Urutan protein aktin dari ameba dan dari hewan identik pada 80 persen posisi asam amino meskipun sekitar satu miliar tahun evolusi.
Gen multiple actin yang ditemukan di dalam eukariota modern terkait dengan gen bakteri yang telah berevolusi untuk berperan dalam sintesis dinding sel bakteri.
Beberapa eukariota bersel tunggal, seperti ragi dan ameba, memiliki satu atau dua gen aktin leluhur, sedangkan organisme multiselular sering mengandung banyak gen aktin.
Misalnya, manusia memiliki enam gen aktin, dan beberapa tanaman memiliki lebih dari 60 gen aktin (walaupun kebanyakan adalah pseudogen, yang tidak menyandikan protein aktin fungsional).
Setiap gen aktin fungsional mengkode isoform protein yang berbeda. Isoform aktin dapat dikelompokkan menjadi tiga kelompok: α-aktin, β-aktin, dan γ-aktin.
Pada vertebrata, empat isoform aktin hadir pada jenis sel otot tertentu, dan dua isoform ditemukan pada sel non-otot. Keenam isoform ini berbeda hanya pada sekitar 25 dari 375 residu dalam protein lengkap, atau menunjukkan sekitar 93 persen identitas.
Meskipun perbedaan di antara isoform tampak kecil, ketiga jenis isoform memiliki fungsi yang berbeda: α-aktin dikaitkan dengan struktur kontraktil, γ-aktin untuk filamen dalam stress fiber, dan β-aktin diperkaya dalam korteks sel dan ujung tombak sel motil.
Referensi
Molecular Cell Biology Lodish, 8th Edition, chapter 17.
Molecular Biology of The Cell Albert, 6th Edition, chapter 16.
Mikrofilamen dan struktur aktin
Mikrofilamen dapat dirakit menjadi berbagai jenis struktur dalam sel. Masing-masing struktur beragam ini mendasari fungsi seluler tertentu (Gambar 17-4a).
Mikrofilamen bisa berupa bundel ketat filamen yang membentuk inti dari mikrovili yang ramping dan seperti jari, tapi juga dapat ditemukan di jaringan yang kurang teratur di bawah membran plasma, yang dikenal sebagai korteks sel, di mana mereka memberi dukungan dan pengorganisasian.
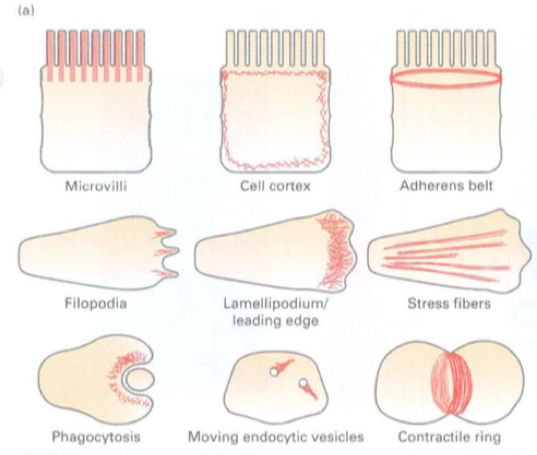
Gambar 17.4 Contoh struktur berbasis mikrofilamen. (a) Di setiap panel, mikrofilamen digambarkan berwarna merah.
Pada sel epitel, mikrofilamen membentuk pita kontraktil di sekitar sel, adherens belt, yang terkait erat dengan persimpangan adheren untuk memberi kekuatan pada epitel.
Pada sel yang bermigrasi, jaringan mikrofilamen ditemukan di bagian depan sel di leading edge, atau lamellipodium, yang juga dapat memiliki bundel filamen yang menonjol yang disebut filopodia.
Banyak sel memiliki mikrofilamen kontraktil yang disebut stress fibers, yang menempel pada lapisan luar melalui daerah khusus yang disebut focal adhesions (FAs) atau focal contacts.
Sel khusus seperti makrofag menggunakan mikrofilamen kontraktil dalam proses yang disebut fagositosis untuk menelan dan menginternalisasi patogen (seperti bakteri), yang kemudian dihancurkan secara internal.
Contoh lain yaitu bagian sangat dinamis, rentetan pendek dari perakitan filamen aktin dapat menggerakkan pergerakan vesikula endositik dari membran plasma.
Pada tahap akhir pembelahan sel pada hewan, setelah semua organel telah diduplikasi dan dipisahkan, bentuk cincin kontraktil dan menyempit untuk menghasilkan dua sel anak dalam proses yang dikenal sebagai sitokinesis.
Jadi, sel menggunakan filamen aktin dalam banyak hal: dalam peran struktural, dengan memanfaatkan kekuatan polimerisasi aktin untuk melakukan tugasnya, atau sebagai jalur untuk motor myosin.
Mikrograf elektron pada Gambar 17-4b menunjukkan mikrofilamen pada mikrovili. Pengaturan mikrofilamen yang berbeda sering kali hidup berdampingan dalam sel tunggal, seperti yang ditunjukkan pada Gambar 17-4c, dalam kasus fibroblast yang bermigrasi.

(b) Mikrograf SEM dari daerah apikal sel epitel terpolarisasi, menunjukkan bundel filamen aktin yang membentuk inti mikrovili. (c) Sel bergerak menuju bagian atas halaman, diwarnai untuk aktin dengan fluoresen phalloidin, obat yang secara khusus mengikat F-actin. Perhatikan ada 3 jenis bentuk yang berbeda bisa eksis dalam satu sel.
Blok bangunan dasar mikrofilamen adalah aktin, protein yang memiliki sifat luar biasa untuk merakit kembali menjadi filamen terpolarisasi dengan ujung yang berbeda secara fungsional. Filamen ini kemudian dicetak ke dalam berbagai struktur yang dijelaskan pada paragraf sebelumnya oleh protein pengikat aktin.
Nama mikrofilamen mengacu pada aktin dalam bentuk polimernya, dengan protein yang terkait. Pada bagian ini, kita melihat protein aktin itu sendiri dan filamen yang dirakitnya.
Referensi
Molecular Cell Biology Lodish, 8th Edition, chapter 17, p.778
Image: https://micro.magnet.fsu.edu/primer/techniques/fluorescence/gallery/cells/apm/apmcellsexlarge4.html

