Rifamisin (rifamycins) bisa dikatakan antibiotik “aksesori”. Sama seperti dompet bergaya atau kalung berkilau digunakan untuk menghiasi gaun, agen antimikroba ini ditambahkan ke perawatan tradisional yang membutuhkan sedikit penekanan untuk efek yang optimal.
Anggota dan struktur kimia
Rifamisin terdiri dari rifampin (juga disebut rifampisin), rifabutin, rifapentin, dan rifaksimin (Tabel 1). Masing-masing memiliki struktur serupa yang mencakup inti aromatik yang dihubungkan pada kedua ujungnya oleh “pegangan” alifatik (Gambar 1).


Mekanisme aksi rifamisin dan resistensi
Rifamisin beraksi dengan menghambat RNA polimerase bakteri. Rifamisin masuk jauh ke dalam terowongan DNA/RNA dari enzim, dan saat bersarang di posisi ini, secara sterik menghalangi perpanjangan/elongasi molekul mRNA yang baru terbentuk.
Resistensi berkembang relatif mudah dan bisa berasal dari salah satu dari beberapa mutasi pada gen bakteri yang menyandi RNA polimerase. Mutasi-mutasi ini masing-masing hanya mengubah satu asam amino di tempat di mana rifamisin berikatan dengan RNA polimerase tetapi cukup untuk mencegah pengikatan.
Karena mutasi tunggal cukup untuk menyebabkan resistensi, rifamisin biasanya digunakan dalam kombinasi dengan agen lain untuk mencegah munculnya strain resisten.
Aktivitas antimikroba rifamisin
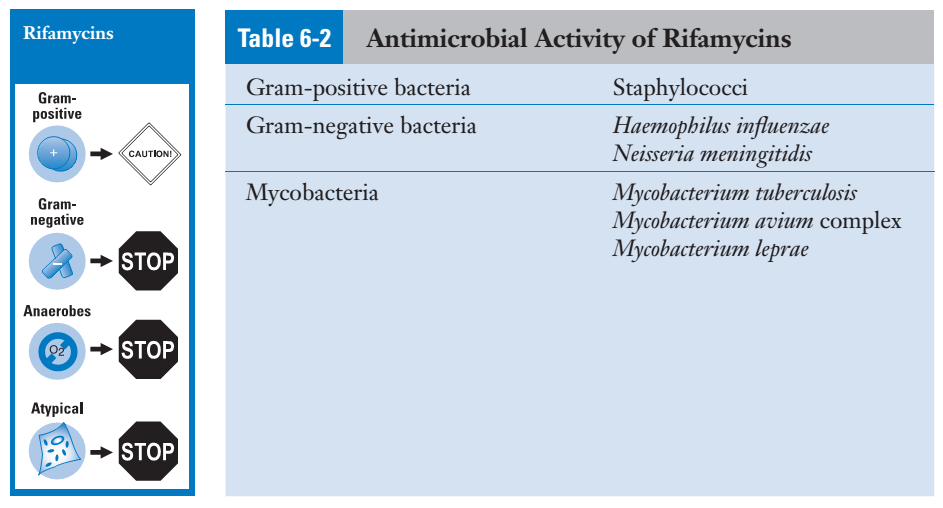
Rifamisin sering digunakan dalam rejimen kombinasi untuk pengobatan infeksi mikobakteria (Tabel 2).
Rifampisin
Rifampisin telah digunakan bersama dengan antibiotik lain untuk mengobati infeksi stafilokokus. Rifampisin juga efektif sebagai monoterapi untuk profilaksis terhadap Neisseria meningitidis dan Haemophilus influenzae.
Penggunaan rifampisin tunggal dalam profilaksis dibenarkan oleh fakta bahwa, biasanya, sangat sedikit bakteri yang hadir tanpa adanya penyakit yang jelas, sehingga meminimalkan kemungkinan bahwa mutasi resistansi rifampisin akan terjadi secara spontan.
Rifampin
Rifampin is the oldest and most widely used of the rifamycins. It is also the most potent inducer of the cytochrome P-450 system.
Rifabutin
Rifabutin is favored over rifampin in individuals who are simultaneously being treated for tuberculosis and HIV infection because it inhibits the cytochrome P-450 system to a lesser degree than rifampin or rifapentine and thus can be more easily administered along with the many antiretroviral agents that also interact with this system.
Rifapentin
Rifapentine has a long serum half-life, which has led to its use in once-weekly regimens for immunocompetent patients with tuberculosis.
Rifaksimin
Rifaximin is a poorly absorbed rifamycin that is used for the treatment of travelers’ diarrhea. Because it is not systemically absorbed, it has limited activity against invasive bacteria, such as Salmonella and Campylobacter spp.
Toksisitas
The rifamycins are potent inducers of the cytochrome P-450 system. Thus, they may dramatically affect the levels of other drugs metabolized by this system. Rifamycins also commonly cause gastrointestinal complaints such as nausea, vomiting, and diarrhea and have been associated with hepatitis. Skin rashes and hematologic abnormalities may also occur. Of note, rifampin causes an orange-red discoloration of tears, urine, and other body fluids, which can lead to patient anxiety and the staining of contact lenses. Rifabutin has been associated with uveitis.
Sejarah

Nama rifamycin diturunkan dari film Prancis berjudul Rififi, yang sedang populer ketika obat ini ditemukan.
Sensi P. History of the development of rifampin. Rev Infect Dis. 1983;5(suppl 3):S402–S406.
The rifamycins are used primarily as components of multidrug regimens for mycobacterial infections and some staphylococcal infections. The ease with which bacteria develop resistance to these agents precludes their use as monotherapy in active disease.
Bacaan lebih lanjut
- Burman WJ, Gallicano K, Peloquin C. Comparative pharmacokinetics and pharmacodynamics of the rifamycin antibacterials. Clin Pharmacokinet. 2001;40:327–341.
- Campbell EA, Korzheva N, Mustaev A, et al. Structural mechanism for rifampicin inhibition of bacterial RNA polymerase. Cell. 2001;104:901–912.
- Huang DB, DuPont HL. Rifaximin—a novel antimicrobial for enteric infections. J Infect. 2005;50:97–106.
- Munsiff SS, Kambili C, Ahuja SD. Rifapentine for the treatment of pulmonary tuberculosis. Clin Infect Dis. 2006;43:1468–1475.
Pertanyaan/Evaluasi
- Rifampin binds bacterial __________________ and inhibits synthesis of __________________.
- Rifampin is used primarily in the treatment of diseases caused by __________________ and __________________.
- The rifamycins are usually used in conjunction with other antimicrobial agents because __________________ to rifamycins develops during monotherapy.
Jawaban
- RNA polymerase; mRNA
- mycobacteria, staphylococci
- resistance